*
Intérêt des modèles canins de
myopathies
héréditaires * Recherche de procédés thérapeutiques * Développement d’outils d’évaluation fonctionnelle  |
Recherche de procédés thérapeutiques Depuis de 1996, l’UETM est impliquée dans la mise au point d’essais thérapeutiques. Différentes approches sont considérées et la majorité d’entre elles font appel au modèle GRMD pour lequel des outils spécifiques d’évaluation ont été développés par l’équipe. Greffe de
mésoangioblastes Les
mésoangioblastes sont des cellules
souches adultes associées aux vaisseaux sanguins, capables
de se différencier en
cellules de la lignée mésodermique, et notamment
en cellules de muscle
squelettique. Ces cellules présentent
l’intérêt de franchir les
endothéliums
vasculaires des premiers capillaires qu’elles rencontrent et
d’être attirées
par les contextes inflammatoires, fréquents dans les
processus
myopathiques. La capacité des mésoangioblastes
à rejoindre le muscle depuis le
compartiment vasculaire a été
démontré in vivo chez des
souris dystrophiques (Sampaolesi et
al., 2003).
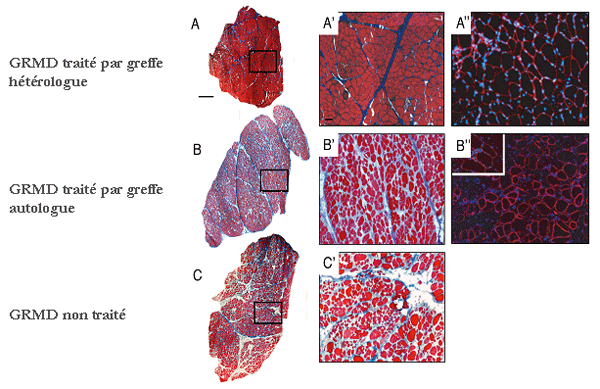
(A-C') Marquage
Azan Mallory sur coupes transversales de biopsies musculaires
effectuées chez un chien traité par greffe
hétérologue (mésoangioblastes venant
d'un donneur
sain) (A,A'), chez un chien traité
par greffe autologue (mésoangioblastes
venant du chien malade lui-même et corrigés
génétiquement) (B,B'), et chez un chien
non traité (C, C'). Ces résultats
prometteurs donnent un
nouvel élan à la recherche en matière
de thérapie cellulaire. Cependant, un
point reste à éclaircir. Chez les chiens GRMD
traités, nous avons observé que
l’expression de Saut
d’exon thérapeutique Chez les chiens GRMD, le
gène codant pour 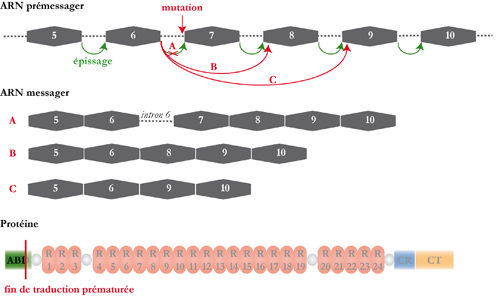 Le
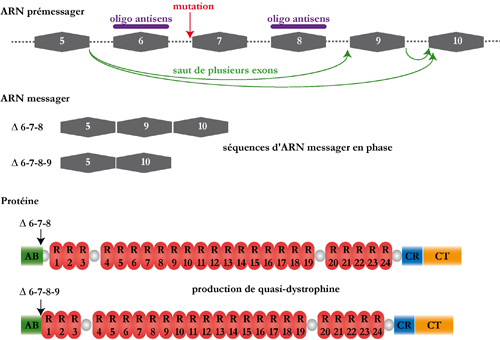
saut d’exon thérapeutique est une
stratégie qui consiste à rétablir un
cadre de
lecture fonctionnel en empêchant
l’incorporation d’un ou plusieurs exons lors du
processus
d’épissage. Pour ce faire des
oligonucléotides
antisens sont utilisés pour masquer des régions
nécessaires à l'épissage. Dans le
cas particulier de la dystrophine canine, l’excision des
exons 6
à 8 du
transcrit restaure un cadre de lecture
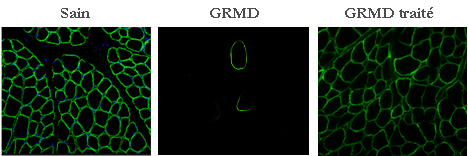
opérationnel. En collaboration avec le groupe de Luis Garcia de l’Institut de Myologie (Pitié-Salpêtrière), nous évaluons le bénéfice biologique apporté par cette stratégie chez le chien GRMD. Le saut d’exon est induit à l’aide d’oligonucleotides anti-sens complémentaires des sites d’épissage exoniques (ESE) des exons 6 et 8. Afin de protéger les oligonucleotides des processus de dégradation cellulaire, ils ont été associés à de petits ARNs nucléaires (U7snRNAs). Les constructions sont vectorisés dans des AAV (Adeno-Associated Virus) non réplicatifs produits par le groupe de Robert Kotin (Laboratoire de Biochimie et de Génétique, National Institutes of Health, USA). Après injection intramusculaire de la construction vectorisée, nous avons observé l'expression d'une dystrophine tronquée mais encore fonctionnelle, dite « quasi-dystrophine ».
Nos résultats démontrent pour la première fois qu’il est possible d’induire un saut multi-exonique, et ce chez un animal de grande taille. Une telle stratégie, appliquée aux êtres humains, permettrait d’augmenter de manière considérable le nombre de patients susceptibles d’être traités par saut d’exon thérapeutique. Nos résultats apportent aujourd’hui une preuve de principe, cependant, avant d’envisager des essais cliniques humains, il nous faut développer une méthode d’administration systémique. |